Perché la FDA nasconde i dati sulla reazione alla vaccinazione COVID e non vuole pubblicare i dati sulla reazione alla vaccinazione COVID per 55 anni?

- Nel settembre 2021, un gruppo chiamato Public Health and Medical Professionals for Transparency (PHMPT) ha presentato un'applicazione per il Freedom of Information Act (FOIA) alla FDA per ottenere i documenti utilizzati per approvare la Commissione. Quando la FDA non ha risposto dopo un mese, il PHMPT ha intentato una causa.
- La Food and Drug Administration (FDA) statunitense ha impiegato 108 giorni per "approfondire e completare le 329.000 pagine di dati che Pfizer / BioNTech ha presentato per ricevere l'approvazione della FDA per la siringa COVID di Comirnaty, che è stata approvata il 3 agosto 2021".
- La FDA ora afferma che impiegheranno 55 anni per pubblicare le stesse pagine al pubblico (al ritmo di 500 pagine al mese) poiché ogni pagina deve essere rivista e le informazioni sensibili oscurate.
- Finora la FDA ha approvato solo 91 pagine. Da questi documenti, Pfizer ha ricevuto 42.086 segnalazioni di eventi avversi, inclusi 1.223 decessi, entro i primi 2,5 mesi dall'introduzione della siringa Pfizer.
- Mentre Pfizer ammette che il numero di segnalazioni spontanee di eventi avversi era così alto che l'azienda ha dovuto assumere un numero sfigurato di personale aggiuntivo a tempo pieno per gestire l'immissione di dati aggiuntivi, Pfizer afferma che "i risultati di queste analisi di rilevamento del segnale corrispondono al noto Corrispondenza del profilo di sicurezza del vaccino”. Se prevedevano un numero così elevato di infortuni, allora perché non hanno assunto alcuna assunzione - e perché la FDA ritiene che il numero di nuove assunzioni sia un'informazione riservata?
La Food and Drug Administration degli Stati Uniti ha impiegato 108 giorni per rivedere tutti i dati presentati da Pfizer / BioNTech al fine di ottenere l'approvazione della FDA per la siringa COVID di Comirnaty, che è stata approvata il 3 agosto 2021.
Dato che l'agenzia afferma che i dati sono 329.000 pagine, il fatto che siano stati in grado di leggerli, analizzarli e trarre conclusioni sulla sua sicurezza ed efficacia in soli 108 giorni - che sono all'incirca le stesse 80.000 pagine al mese - non c'è da meravigliarsi. È necessario impiegare alcuni lettori ad alta velocità molto efficienti.
Ed è per questo che l'affermazione della FDA secondo cui ci vorrà mezzo secolo per rivedere i documenti prima di poterli rilasciare al pubblico non sembra molto credibile. Anche l'agenzia di stampa Reuters, il cui ex amministratore delegato siede nel consiglio di amministrazione di Pfizer, è rimasta scioccata.
Richiesta urgente FOIA per dati Comirnaty
Nel settembre 2021, un gruppo chiamato Public Health and Medical Professionals for Transparency (PHMPT) ha presentato un'applicazione per il Freedom of Information Act (FOIA) alla FDA per ottenere i materiali utilizzati per approvare la Commissione.
Ciò include dati sulla sicurezza e sull'efficacia, segnalazioni di effetti avversi ed elenchi di ingredienti attivi e inattivi. Sono state inoltre presentate circa 400 ulteriori richieste FOIA da parte di altre persone per tutte o parte di queste informazioni
Nella loro domanda FOIA, il PHMPT ha chiesto all'agenzia di accelerare il rilascio dei documenti - una richiesta ragionevole considerando che non abbiamo dati grezzi e le vaccinazioni vengono somministrate a bambini di 5 anni.
Le linee guida FOIA contengono due condizioni in base alle quali un'applicazione può essere accelerata. Uno è "se la mancanza di un trattamento accelerato potrebbe ragionevolmente rappresentare una minaccia per la vita o l'integrità fisica di una persona", che potrebbe facilmente essere il caso qui.
La seconda condizione è “quando il pubblico ha urgente bisogno di essere informato su un'attività effettiva o presunta del governo federale, purché sia fornita da una persona che si occupa principalmente della diffusione delle informazioni”. Anche questo è chiaramente vero.
In un momento in cui i regolamenti sulla vaccinazione COVID-19 vengono applicati contro l'opposizione di coloro che hanno domande sui dati e le informazioni che dimostrano la sicurezza e l'efficacia del vaccino Pfizer e coloro che hanno tali domande dal lavoro, dalla scuola, dal traffico e dai militari sono escluso, il pubblico ha un bisogno urgente e immediato di avere accesso a questi dati, ha affermato il PHMPT nella sua mozione.
La FDA ora vuole 55 anni per il rilascio dei dati sulla vaccinazione COVID J
Quando la FDA non aveva ancora risposto alla richiesta FOIA dopo un mese, il PHMPT ha intentato una causa. La FDA sta ora chiedendo a un giudice federale il permesso di posticipare il rilascio completo di tutti i documenti fino al 2076 - 55 anni da oggi.
Secondo l'avvocato del Dipartimento di Giustizia degli Stati Uniti (DOJ) che rappresenta la FDA sul caso, l'agenzia sarà in grado di "assegnare più pagine a più richiedenti" se gli sarà consentito di aderire a un programma continuo di 500 pagine ogni mese, "evitando un sistema in cui poche query di grandi dimensioni monopolizzano risorse di elaborazione limitate".
L'agenzia afferma di avere solo dieci persone responsabili del rilascio dei documenti FOIA e, prima che il materiale possa essere rilasciato, un funzionario della FDA deve rivedere i documenti e rivedere qualsiasi informazione che includa le informazioni personali dei partecipanti alla sperimentazione clinica, nonché rivelare informazioni commerciali riservate o segreti commerciali .
Ai sensi del FOIA Act del 1967, le agenzie federali sono tenute a rispondere alle richieste FOIA entro 20 giorni, a meno che non vi siano "circostanze insolite" che impediscano l'autorizzazione tempestiva. Le circostanze che potrebbero giustificare un periodo di rilascio esteso includono:
- Casi in cui i documenti di risposta devono essere ricercati e ritirati da un luogo diverso da quello che elabora la domanda
- Situazioni in cui è necessario compilare “grandi” quantità di documenti e
- Casi che richiedono la consultazione con un'altra agenzia federale che ha un interesse significativo nelle informazioni.
L'avvocato del DOJ sottolinea che in altri casi il tribunale ha consentito un programma per il rilascio di un massimo di 500 pagine al mese e la FDA dovrebbe concedere lo stesso margine di manovra qui.
Sebbene possa eseguire questa revisione intensiva dei documenti di Pfizer in 108 giorni, ora richiede oltre 20.000 giorni per rendere tali documenti disponibili al pubblico. ~ Aaron Siri, avvocato presso PHPMT
I querelanti, d'altra parte, sostengono che l'agenzia dovrebbe essere in grado di cancellare tutto entro l'inizio di marzo 2022. Sottolineano che la FDA ha 18.000 dipendenti e un budget annuale di $ 6 miliardi. Tra il 2008 e il 2017, l'agenzia ha elaborato 114.938 domande FOIA, di cui ha concesso il 72,4% in tutto o in parte.
Di questi, il 39,8% è stato valutato "complesso" e l'81,5% di queste complesse domande FOIA è stato elaborato entro 61 giorni o più. Alla luce di queste statistiche storiche, un arretrato di 400 richieste FOIA non sembra eccessivamente gravoso.
La lentezza della FDA è sospetta
A questo si aggiunge lo spinoso problema che la FDA ha già dimostrato di poter condurre una rapida revisione. Aaron Siri dello studio legale Siri & Glimstad ha scritto nel verbale del tribunale del PHMPT:
Questo periodo di 108 giorni corrisponde al tempo impiegato dalla FDA per rivedere la documentazione pertinente per il compito molto più complicato di approvare il vaccino COVID-19 di Pfizer...
La FDA ha impiegato esattamente 108 giorni dal momento in cui Pfizer ha iniziato a presentare la richiesta di approvazione al momento in cui la FDA ha approvato il vaccino Pfizer. Se prendi in parola la FDA, ha condotto una revisione e un'analisi intensiva, solida, approfondita e completa di questi documenti per garantire che il vaccino di Pfizer fosse sicuro ed efficace per l'approvazione.
Sebbene possa eseguire questa revisione intensiva dei documenti Pfizer in 108 giorni, ora ha bisogno di oltre 20.000 giorni per rendere questi documenti disponibili al pubblico...
L'intero scopo del FOIA è garantire la trasparenza del governo. È difficile immaginare che ci sia un bisogno maggiore di trasparenza rispetto alla divulgazione istantanea dei documenti su cui si basa la FDA per concedere in licenza un prodotto che viene ora utilizzato da oltre 100 milioni di americani con la minaccia di perdere le loro carriere, il loro reddito, il loro stato di servizio militare e molto peggio.
Rivelazioni scioccanti nel primo lotto di documenti FOIA
Due mesi dopo la presentazione della causa, la FDA ha rilasciato un lotto di 91 pagine e, se quel lotto è indicativo, non sorprende che la FDA stia pianificando di ritardare il rilascio delle pagine rimanenti. In un articolo di Substack del 21 novembre 2021, Kyle Becker cita direttamente i documenti declassificati:
Si stima che circa [RIDOTTE] dosi di BNT162b2 siano state spedite in tutto il mondo da quando è stata ricevuta la prima approvazione temporanea per le cure di emergenza dal 1 dicembre 2020 al 28 febbraio 2021", si legge nel documento. Cumulativamente, c'erano un totale di 42.086 case report entro il 28 febbraio 2021 (25.379 confermati da medici e 16.707 non confermati da medici) con 158.893 eventi
La maggior parte dei casi (34.762) è stata segnalata da Stati Uniti (13.739), Regno Unito (13.404), Italia (2.578), Germania (1913), Francia (1506) e Portogallo (866). Quella che segue è una panoramica generale degli eventi avversi segnalati:
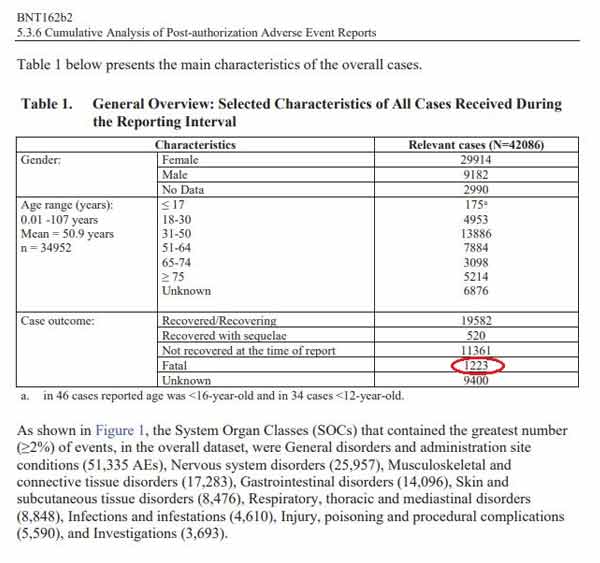
Il diagramma elenca 1.223 conseguenze fatali nei casi rilevanti. È interessante notare che la fascia di età con i casi più rilevanti era compresa tra i 31 e i 50 anni, che non è la fascia di età considerata particolarmente a rischio per il COVID-19.
Vale la pena notare che l'annerimento del numero indicato di dosi spedite renderà più difficile valutare il potenziale rapporto di danno. Ma anche senza ciò, 42.086 segnalazioni di feriti, inclusi 1.223 decessi, sono di per sé un segnale significativo, soprattutto se si considera che il vaccino contro l'influenza suina del 1976 è stato ritirato dopo 25 morti.
Disprezzo palese per la vita
È ancora più preoccupante se si considera che Pfizer ha ricevuto queste 42.086 segnalazioni nei primi 2,5 mesi dopo l'introduzione della siringa. Pfizer ammette persino che il numero di infortuni è insolitamente alto, ma lo liquida come insignificante. Come osserva Siri in un articolo di Substack del 19 novembre 2021 che parla di questo primo lotto di documenti:
Pfizer afferma a pagina 6 che "a causa del gran numero di segnalazioni spontanee di eventi avversi ricevuti per il prodotto, [Pfizer] ha dato la priorità alla gestione dei casi gravi..."
Pfizer "ha anche adottato diverse misure per mitigare l'aumento delle segnalazioni di eventi avversi", tra cui "l'aumento del numero di colleghi per l'inserimento dei dati e la gestione dei casi" e "l'assunzione di circa [RIDOTTO] ulteriore personale a tempo pieno".
Sorge la domanda: perché è proprietario condividere quanti dipendenti Pfizer ha dovuto assumere per tenere traccia di tutti gli eventi avversi segnalati poco dopo il lancio del suo prodotto...
Ma nessun motivo di preoccupazione, come dice Pfizer alla FDA: "I risultati di queste analisi di rilevamento del segnale sono coerenti con il noto profilo di sicurezza del vaccino". Quindi, se sapevano che questi problemi sarebbero sorti, perché non sembravano avere abbastanza personale per gestire il volume previsto di segnalazioni?
La grande conclusione di Pfizer alla FDA: i dati non rivelano nuovi problemi di sicurezza o rischi che richiederebbero una modifica dell'etichettatura e supportano un profilo rischio-beneficio favorevole per il vaccino BNT162b2. Non c'è niente da vedere qui.
Naturalmente, c'è molto da vedere nelle centinaia di migliaia di documenti che Pfizer/BioNTech ha depositato presso la FDA. Il fatto che la FDA stia ostacolando e impiegando 55 anni per modificare prima che siano disponibili al pubblico è di per sé eloquente.
Non ci vuole un'immaginazione fantasiosa per capire cosa potrebbero nascondere. Sembra quasi come cercare di assicurarsi che i responsabili siano tutti morti fino a quando l'intero set di dati non sarà disponibile pubblicamente e le persone potranno essere ritenute responsabili delle loro decisioni. Speriamo che il giudice sia più interessato alla salute pubblica che alla protezione degli sporchi segreti della FDA.
Fonti:
- 1 ZeroHedge 23 novembre 2021
- 2, 7 Daily Mail 19 novembre 2021, aggiornato il 20 novembre 2021
- 3, 4 Il difensore 19 novembre 2021
- 5 Corte distrettuale degli Stati Uniti Distretto settentrionale del Texas Caso 4:21-cv-01058-P
- 6 Corte distrettuale degli Stati Uniti Distretto settentrionale del Texas Caso 4:21-cv-01058-P Secondo rapporto congiunto
- 8 La reazione al vaccino 21 novembre 2021
- 9 documenti Pfizer su PHMPT.org
- 10 thekylebecker.substack.com 21 novembre 2021
- 11 aaronsiri.substack.com 19 novembre 2021
Commenti
Posta un commento